Caffeina = Teina: un’identità poco nota
Teina o caffeina? qualche curiosità su una molecola che ha tanti nomi.
Quando sono arrivato all’università ero fermamente convinto che caffeina e teina fossero due cose completamente diverse. Pensavo che fossero due molecole fondamentali nella composizione di caffè e tè rispettivamente.
È vero, al primo anno non sapevo granché di chimica, ma anche quando ho iniziato a masticare qualcosa in più, nella mia ment
e, teina e caffeina erano diventate due molecole distinte, accomunate magari nella struttura da qualche gruppo funzionale identico.
Mi imbarazza ammettere che la realtà dei fatti sono riuscito a scoprirla solo durante un laboratorio didattico: teina e caffeina sono semplicemente sinonimi che indicano la stessa molecola.
Vengono entrambi utilizzati per identificare quella che, scientificamente parlando, viene chiamata 1,3,7-trimetilxantina o 7-metilteobromina.
Questa sostanza, un alcaloide, non è contenuta soltanto nelle piante di tè e caffè, ma anche in cacao, cola, guaranà… (al solito, Wikipedia fornisce un’ottima descrizione).
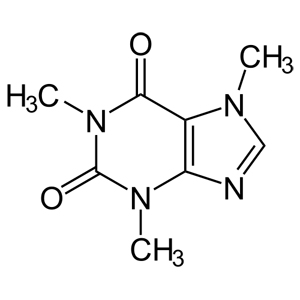
In natura questa molecola svolge il ruolo di insetticida, al fine di evitare che le piante vengano attaccate da artropodi vari: sui ragni, ad esempio, ha effetto disorientante ed impedisce loro di poter tessere delle ragnatele che abbiano una solida struttura.
Per l’uomo risulta essere una sostanza psicoattiva, dall’effetto stimolante.
In realtà, tutte le sostanze che fanno parte degli alcaloidi, come ad esempio la morfina, hanno un qualche tipo di effetto farmacologico. Addirittura, l’assunzione di caffeina con frequenza e dosi elevate può risultare in una dipendenza da essa, nota come caffeinismo.
Un aspetto a mio avviso interessante riguardo la caffeina (o teina, che dir si voglia) è rappresentato dal suo percorso metabolico nel nostro corpo. Essa infatti viene in parte trasformata dal fegato in un’altra molecola: la teobromina, nota a molti come la molecola del cioccolato.
La teobromina è infatti un altro alcaloide contenuto in abbondanza nelle piante di cacao, molto simile alla caffeina come struttura.
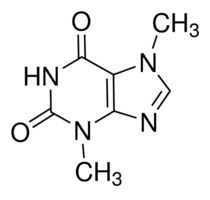
Sul corpo umano agisce da vasodilatatore, oltre che da calmante della tosse, ed amplifica l’effetto stimolante della caffeina.
In un certo senso possiamo affermare che tè, cioccolato e caffè hanno effetti simili sul nostro corpo, dovuti alla presenza di queste sostanze psicoattive. Vale la pena però sottolineare che la concentrazione di queste varia molto a seconda della provenienza ed è abbastanza palese che il caffè rappresenta la fonte più concentrata.
Il limite di tolleranza della caffeina per l’uomo può variare da soggetto a soggetto, ma si può approssimare la dose letale per una persona di 70 Kg a circa 10 g di sostanza, equivalenti all’assunzione di 130 tazzine di caffè espresso o 170 tazze di tè (valore che può variare a seconda del tipo di tè), bevute una di seguito all’altra.
Per concludere, mi ha un po’ rincuorato scoprire che la dimostrazione del fatto che teina e caffeina fossero la stessa molecola è avvenuta solo verso la fine del 1800, grazie agli studi che condussero alla definizione chiara della sua struttura, nonché alla sintesi vera e propria di questa sostanza. Studi che fecero parte dell’assegnazione del premio Nobel per la chimica nel 1902 a Hermann Emil Fischer, un personaggio che chi, come me, ha a che fare con la chimica tutti i giorni, sente nominare piuttosto spesso.

 Ormai in quasi ogni supermercato, specialmente nel periodo invernale e nei reparti “tutto a 1€”, si trovano degli oggetti di varie forme e dimensioni simili a bustine con del liquido all’interno, chiamati scaldamani.
Ormai in quasi ogni supermercato, specialmente nel periodo invernale e nei reparti “tutto a 1€”, si trovano degli oggetti di varie forme e dimensioni simili a bustine con del liquido all’interno, chiamati scaldamani.



 Ecco spiegato come il liquido contenuto all’interno del bicchiere con la scritta CHRIST non si colori all’aggiunta della tintura di iodio.
Ecco spiegato come il liquido contenuto all’interno del bicchiere con la scritta CHRIST non si colori all’aggiunta della tintura di iodio.


 Fatevi dare un bicchiere di plastica che voi non avete mai visto.
Fatevi dare un bicchiere di plastica che voi non avete mai visto.